推荐精英
推荐新闻
- 2017/05/12贸易保护主义有所抬头 中国对外投资该如何应对
- 2017/05/12外汇储备跌破3万亿不可怕
- 2017/05/12为实体经济减负 涉企收费继续“做减法”
- 2017/05/12高杠杆收购:危险的资本游戏?
投资部
程序化诱导血管内皮化
程序化诱导血管内皮化
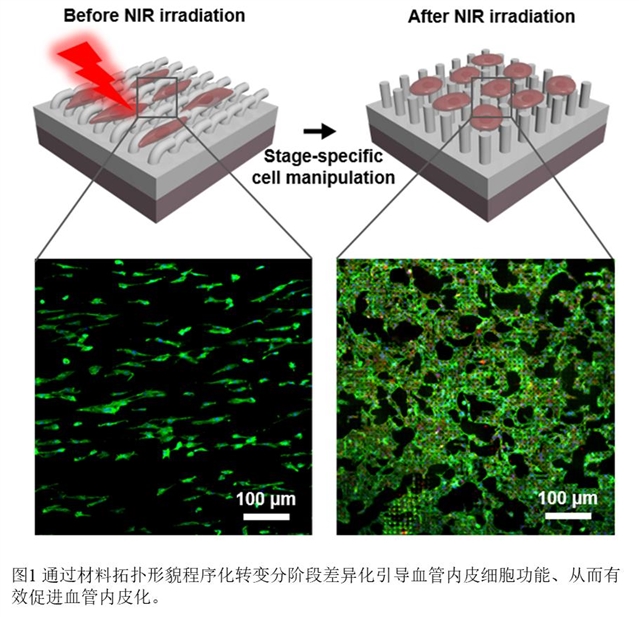
近日,中国科学院深圳先进技术研究院医工所纳米调控中心杜学敏副研究员团队设计构建了拓扑形貌可程序化转变材料,可主动引导血管内皮细胞功能,为血管再生修复中的核心关键问题亟血管内皮化提供了创新解决方案。该项研究成果以“A Stage-Specific Cell Manipulation Platform for On-demand Inducing Endothelialization”为题发表在国际权威综合性期刊National Science Review(《国家科学评论》影响因子13.222)上,杜学敏副研究员是该论文通讯作者,团队成员赵启龙博士与王娟助理研究员为共同第一作者,先进院为唯一通讯单位。
根据世卫组织的统计,目前每年死于心血管疾病的人数占全球死亡人数三成以上。心血管疾病是排名高于癌症及各类传染性疾病的第一大死因。血管再生修复研究对于改善心血管疾病治疗,提高心血管疾病患者存活率和生活质量具有重要意义。在血管再生修复过程中,如何在血管内腔快速形成融合单层的血管内皮细胞单层亟血管内皮化是其中的核心关键,决定了重塑血管的功能性和有效性。为改善血管内皮化,我们在前期工作中开发了具备生物活性、可实现从二维到三维形态转变的血管组织工程支架,有效支持了血管内皮细胞在血管内腔的三维黏附生长,为内皮化创造了有利条件(Adv. Funct. Mater. 2018, 28, 1801027; ACS Appl. Mater. Interfaces 2018, 10, 23583)。然而,在自体内皮化进程,单纯提供适宜血管内皮细胞黏附生长的静态微环境还远远不够。血管内皮细胞在内皮化过程中实际受动态细胞微环境的差异化引导,表现出阶段特异的细胞行为。因此,构筑可程序化诱导血管内皮化的细胞调控材料十分必要。
为实现程序化引导血管内皮化,杜学敏研究团队基于前期构建柔性驱动材料的研究基础(Research 2019, 2019, 6398296; Matter 2019, 1, 626; J. Mater. Chem. A 2018, 6, 24748),成功构建了一种具有光热响应层和动态拓扑形貌层的细胞调控材料,可动态调控血管内皮细胞的行为功能。该形状记忆复合材料在近生理环境下(37℃)具备稳定的各向异性初始形貌,能够显著促进血管内皮细胞在其表面迁移,满足内皮化初期对血管内皮细胞的调控需求;而在不改变细胞培养条件(37 ℃)、仅施加10 s近红外光照射下,材料的拓扑形貌即可由各向异性变为各向同性,在不影响细胞活性的同时,有效引导血管内皮细胞形态和行为从迁移状态转变为黏附铺展状态,促进融合的血管内皮细胞单层的形成,满足了内皮化后期对血管内皮细胞的调控需求。本研究构建的具备可控拓扑形貌表面的材料成功模仿了自体内皮化进程中细胞微环境对血管内皮细胞分阶段、差异化的调控作用,首次实现了血管内皮化的按需引导,为加速血管内皮化进程提出了有效创新策略。并且,相信这种构建可动态调控细胞功能材料的新策略将在伤口修复以及复杂人体组织器官再生修复中具有广阔的应用前景。
上述研究工作得到了国家重点研发计划、国家自然基金、广东省、深圳市等科技项目资助。(来源:科学网)
论文链接:https://doi.org/10.1093/nsr/nwz188
- 上一篇:孕妇生活在油田附近或有早产风险
- 下一篇:保持足够距离可降低新冠感染风险